
新闻动态
NEWS CENTER
2021年9月30日,72周年国庆放假前最后工作日,广东省药品交易中心官网在头条发布关于征求《广东联盟双氯芬酸等153个药品集团带量采购文件(征求意见稿)》意见的通知。
《广东联盟双氯芬酸等153个药品集团带量采购单》第三部分其他药品(非独家药品)中提到了利妥昔单抗注射液,让我们再次看到了广东省药品交易中心将带量集采工作将延续到生物药领域的决心与行动,可能为2021年全国单抗集采打响全国第一枪,对国内生物药带量集采工作将产生重大影响。
一、生物药距离集采还有多远?
生物药是当前最畅销、研究最火的医药产品之一,我国单抗制品虽然起步晚,但发展迅速,尤其在抗肿瘤领域获得了巨大发展,随着越来越多的生物药获批,越来越多的医药人在问:生物药离集采之路还有多远?
1)在2020年10月国家医疗保障局对十三届全国人大三次会议第6450号建议的答复中获悉,“正在研究生物制品集中采购相关政策,生物类似药并非集中带量采购的禁区,在考虑生物类似药的相似性、企业产能和供应链的稳定性、具体产品的临床可替代性等因素的基础上,将适时开展集中带量采购。”
2)2021年1月春节前夕,国务院办公厅发布的《关于推动药品集中带量采购工作常态化制度化开展的意见》文件就明确提出:未过评品种、中成药以及生物类似药将被纳入药品集采;
3)在2021年1月28日的政策宣贯会上,国家医保局副局长陈金甫也明确表示:生物类似药纳入集采是制度性的要求,纳入集采是毫无疑义的。此次《广东联盟双氯芬酸等153个药品集团带量采购文件(征求意见稿)》的发布,进一步证实生物药纳入药品集中带量采购已成定局,并离集采的距离越来越近。
二、利妥昔单抗注射液上市概况
利妥昔单抗注射液由Genentech公司原研,1997年获得美国FDA批准上市,通用名为利妥昔单抗(Rituximab),商品名为RITUXAN®,之后该药物在欧洲(商品名MabThera®)和日本等地相继上市,适应症为:
(1)非霍奇金淋巴瘤(NHL);
(2)慢性淋巴细胞白血病(CLL);
(3)类风湿性关节炎(RA);
(4)多血管性肉芽肿(GPA)和显微镜性多发性血管炎(MPA)。
2000年利妥昔单抗在中国上市,商品名为美罗华®。利妥昔单抗注射液原研产品中国专利已于2013年到期,多家国内外制药企业加入其生物类似药的研发。
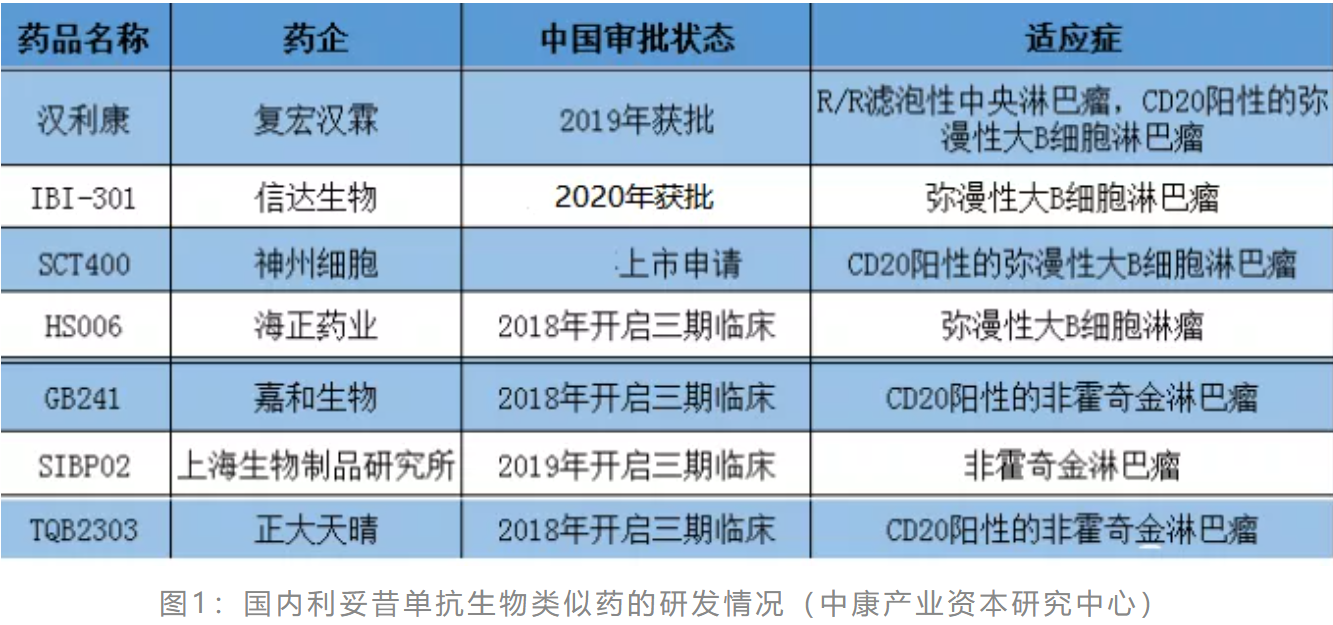
国家药品监督管理局(NMPA)于2019年2月批准上市的上海复宏汉霖生物制药有限公司的利妥昔单抗注射液(汉利康®),为国内首个获批的利妥昔单抗生物类似药,信达生物已于2020年9月批准上市,另外4家已开启三期临床,1家上市申请中,详见图1。
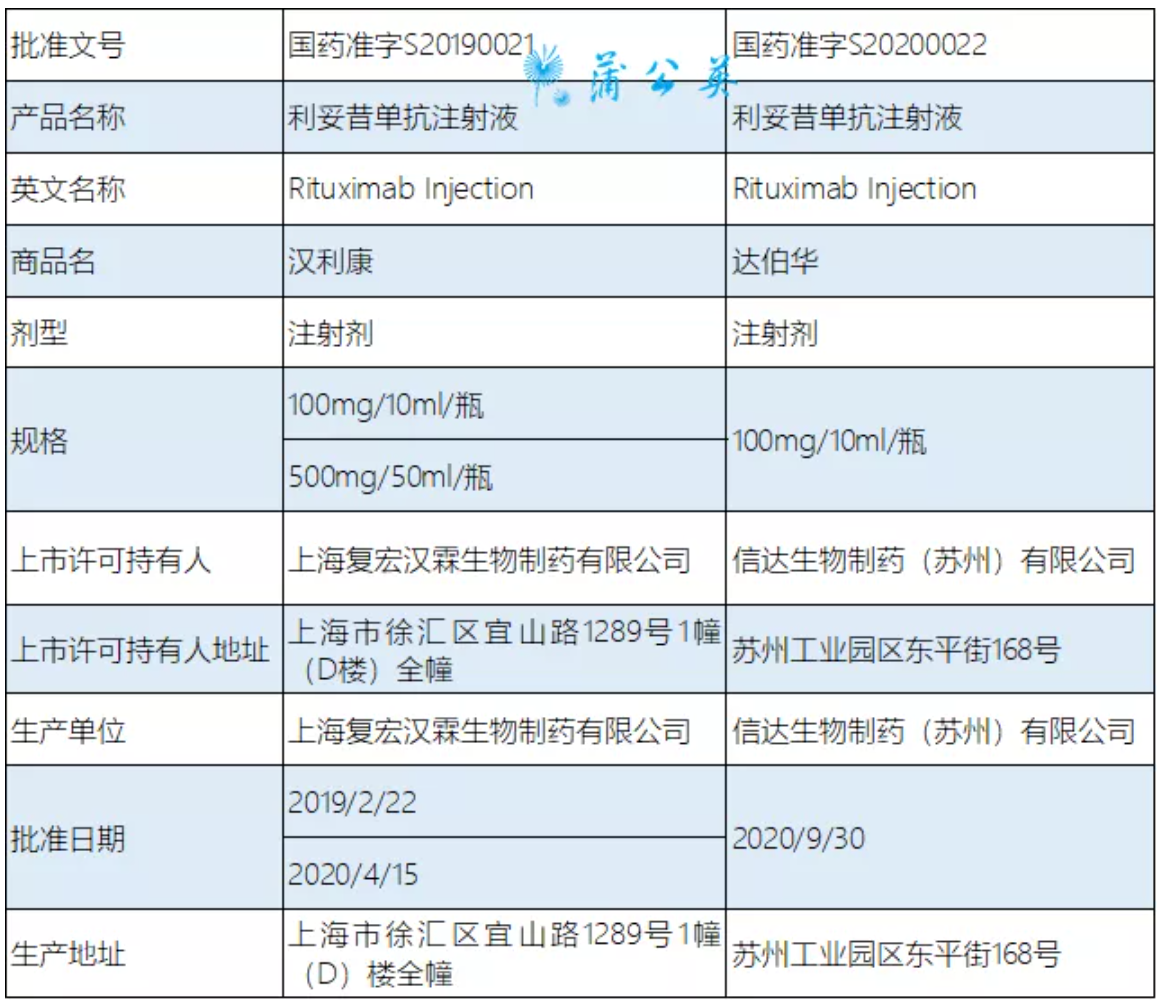
国内已上市批准的国产利妥昔单抗信息详见下表:
扫二维码用手机看
新闻资讯
版权所有 © 北京华大蛋白质研发中心有限公司 京ICP备10024265号-4
 京公网安备 11011302002842号
网站建设:中企动力 北京
京公网安备 11011302002842号
网站建设:中企动力 北京



