
新闻动态
NEWS CENTER
自FDA 1986年批准第一个单克隆抗体以来,目前已经有超过100多个抗体被批准上市,用于治疗病毒感染,肿瘤,自身免疫疾病,代谢性疾病,神经疾病和器官移植等疾病,特别是在肿瘤治疗领域,目前已经有多种类型的抗体如scFvs,ADC,双特异抗体等。从抗体发现方面来看,这些已经批准的抗体主要来源于以下几种技术:杂交瘤,噬菌体展示,酵母展示,人源化小鼠,单个B细胞技术,但究其本质,基本上所有抗体最终都是来自于B细胞(除了一些合成库),因此如何高效的获取特异性B细胞一直以来是抗体发现前进的方向。近日 Cell上发表了一篇名为Single B cell technologies for monoclonal antibody discovery综述对单个B细胞技术的发展进行了汇总。

文章基于B细胞的培养方式将这些技术分为两大类,共6种:1)传统的基于孔板(96或者384)或者玻片等大体积培养的技术,如杂交瘤,记忆B细胞或者ASC(antibody-secreting cells)培养技术及基于BCR的抗原染色技术;2)在微小体积中培养的技术,如Single B cell screening methodologies,B cell replica methodologies,Single B cell repertoire analysis and clonal expansion-guided identification。
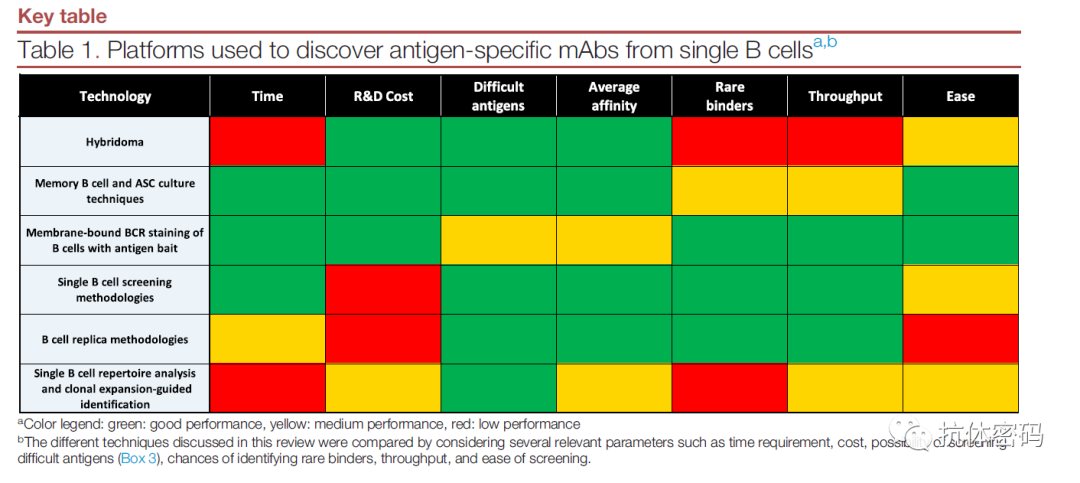
下表汇总了6种技术的优缺点,传统的杂交瘤在费用,亲和力等方面具有一定优势,但是在耗时,通量及特殊抗体(一些特殊表位的抗体)方面有一定的难度;而一些比较成熟的B细胞分选技术各有优缺点,这里不再详细介绍。
杂交瘤
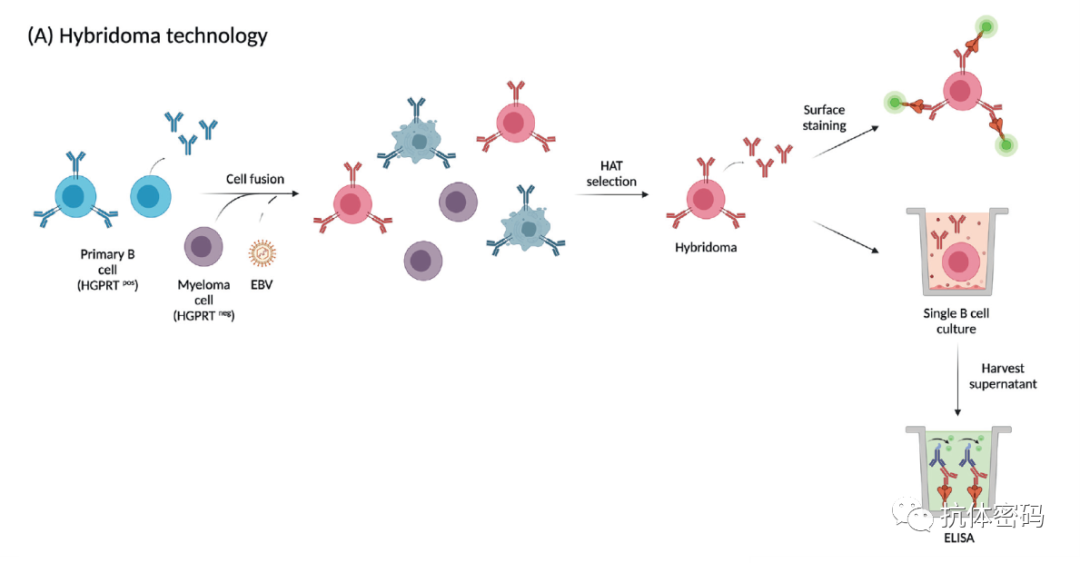
B细胞在体外存活时间较短,因此为鉴别分泌特定抗体的B细胞带来了挑战。为了延长B细胞的存活时间,研究者们开发了B细胞永生化技术,如将B细胞与骨髓瘤细胞融合或者用EBV病毒感染B细胞。
杂交瘤技术是我们熟知的一种B细胞永生化技术,它将能够分泌抗体的B细胞ASCs与骨髓瘤细胞融合,使得ASCs能够获得瘤细胞无限繁殖的优势,并且在生长过程中将抗体分泌于培养伤情以供检测筛选。最初的杂交瘤是小鼠脾细胞与骨髓瘤融合,但是后来有研究者相继开发了骨髓,淋巴结和PBMC等组织细胞的融合技术,并且该技术也被推广到了不同种属如兔子等杂交瘤的制备。融合后利用HAT(次黄嘌呤,氨基碟呤和胸腺嘧啶)培养基进行筛选,排除没有融合的B细胞或者骨髓瘤细胞。为了防止阳性克隆的丢失,一般在融合后的1-2周进行抗体特异性检测,并进行亚克隆形成单克隆。
杂交瘤的缺点是,融合的效率相对较低,因此融合后会丢失很多特异性B细胞。另外,阴性B细胞形成的杂交瘤会与阳性杂交瘤竞争,可能会导致阳性杂交瘤的丢失。
记忆B细胞和ASC培养技术
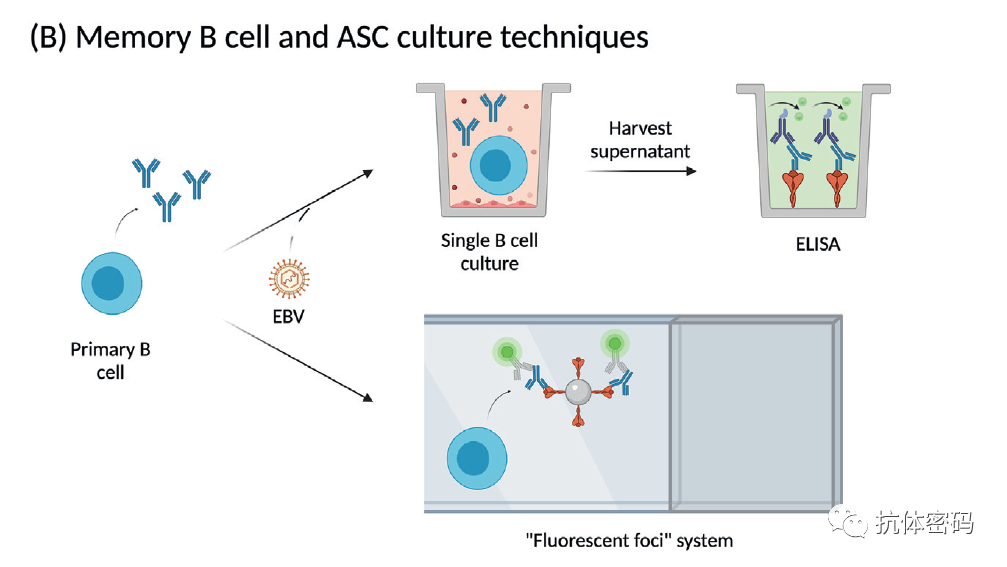
得益于过去20年B细胞培养技术的发展,使得记忆型B细胞不必进行永生化也可以在化学成分确定的培养基中生长。通过特定方法将B细胞分选到96或者384孔板进行培养,培养后既可以进行ELISA筛选也可以进行功能性筛选,如中和试验等。该方法可以筛选到一些特殊功能的抗体,如广谱中和抗体。HIV,SARS-CoV-1的一些广谱中和抗体就是通过该方法筛选的。
另外,基于该培养方式,还可以通过半固体培养基,利用抗原包被磁珠,搭配荧光标记的二抗,筛选能够分泌目标抗体的B细胞,该方法因为利用半固体培养基,因此无需物理上对B细胞进行分离,其筛选基数会更大。
基于BCR的技术的筛选
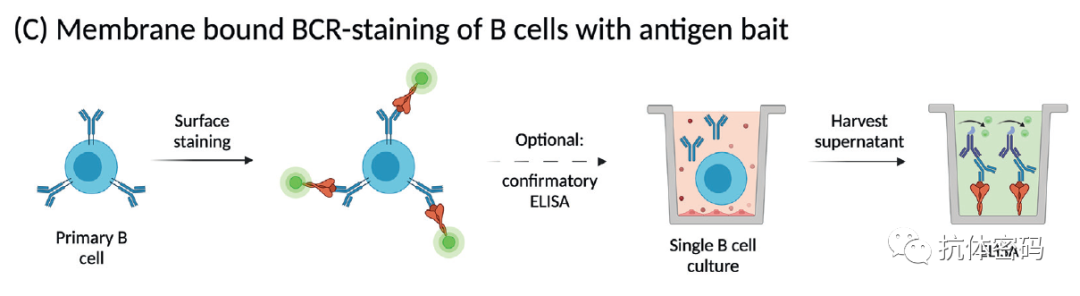
该筛选方法是基于记忆型B细胞表面的抗体(BCR),其主要是对抗原进行标记,如荧光标记,磁珠标记或者是核酸标记,然后利用这些标记的抗原对目标B细胞进行分离,如通过荧光进行FACS筛选。该方法在筛选中容易产生假阳性,因此实际筛选中经常对抗原进行不同的标记,如双荧光或者不同的Tag标签等,进行交叉筛选排除非特异性结合的B细胞。
该技术是目前比较流行的筛选方法,因为其具有较高的通量,较低的成本并且简便易操作。但是由于该方法是基于BCR筛选,因此只能筛选记忆型B细胞,而没有BCR的一些B细胞无法被筛选到。
以上介绍的筛选技术都是基于常规的孔板或者微型玻片技术,但是随着技术的更新和进步,目前出现了多种基于微流控的筛选技术,该技术使得单个B细胞可以在很小体积中培养,使得抗体的浓度很快达到检测限度,因此其时间更短,通量更高。
Single B cell screening methodologies
根据筛选方式的不同,单个B细胞筛选技术可以分为两大类:1)开放式的筛选方式,如Beacon,微流控室,微型雕刻系统和毛细管阵列;2)封闭式的筛选方法,这类筛选都是基于油包水的油珠,将B细胞和检测实际封闭在一个绝对封闭的环境中(下图)

Beacon技术将数千个单个ASCs或激活的记忆B细胞放置在定制的培养芯片上的NanoPen室(体积从740pl到1.7nl不等)。在此过程中,它们会在上清液中分泌抗体。为了检测抗原特异性抗体,包有抗原的微球被放置在NanoPen的正上方,周围有荧光标记的二级抗体。NanoPen室里,分泌的抗体与涂有抗原的微球结合,并被含有荧光二抗检测。筛选阶段通常只需要几分钟到几小时,然后使用一种称为光电子定位(OEP)的结构化光系统进行特定的单体B细胞检索。
微流控室的筛选方法依赖于一个微型雕刻的聚二甲基硅氧烷(PDMS)支架。包被相关抗原的微球被加入到含有单个B细胞的微室内,B细胞分泌的抗体与抗原结合,并被标记的荧光二抗结合,并通过荧光二抗定位目标抗体的B细胞。
另一种小型化技术包括一个微刻系统,在该系统中,0.1-1.0 nl体积的微室被印在PDMS芯片上,ASC通过有限稀释法被分离到这些微室中。为了识别分泌目标抗体的单个ASCs,该系统使用一个预涂有抗原的PDMS/玻璃芯片,由分泌的抗体 "打印 "出来,然后用荧光标记的二抗检测分泌的抗体。或者是将二抗包被在PDMS/玻璃芯片上,然后利用荧光标记的抗原检测目标抗体,对于阳性的B细胞,其对应的芯片上会形成圆形的荧光信号。在这两种情况下,都需要一个特殊的微操纵器来获取目标B细胞。
与前面提到的方法相比,毛细管阵列可以检测更高的通量,其通过将各种40μm的玻璃纤维组合在一起,而不是在PDMS芯片上印刷或雕刻这种方法可以筛选出数百万个体B细胞。与之前的方法一样,对于分泌有目的抗体的检测是通过可移动的包被抗原的芯片进行。随后的单个目标ASC通过毛细管中的氮气进行分离。
在全封闭的检测中,有一种基于微流控技术的系统,其中的水滴被嵌入油基介质中,形成油包水乳剂。这些不同的微流控系统的技术原理与微流控室系统相类似,因为它们也依赖于单一抗原特异性ASC分泌的抗体和一个包被抗原的微球,以及一个捕获抗体的荧光二抗。这方面的一个例外Sphere Fluidics的Cyto-Mine技术,该技术通过共振能量转移(FRET)信号来分析鉴定分泌目标抗体的单个ASC。该信号由一个用供体标记的可溶性抗原和一个用受体探针标记的抗IgG二抗,这样抗原和二抗结合同一个抗体后形成能量共振转移,并被检测。
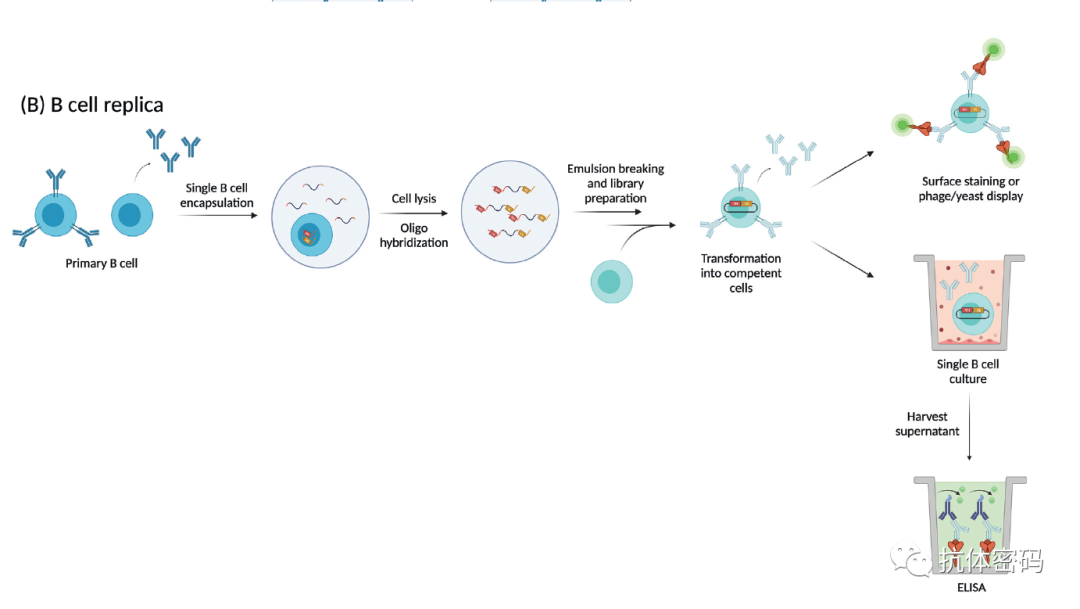
B cell replica methodologie
B细胞“复制”方法颠覆了传统的筛选方法:目标B细胞的筛选首先提取RNA并进行VH-VL目的片段的逆转录,获得目的序列后,将目的序列导入到细胞进行表达。B细胞“复制”方法技术路线如下图所示,首先分离单个B细胞,然后裂解B细胞并进行逆转录构建自然配对的VH-VL库,为了方便后续的展示,VH-VL在构建过程中加入了linker,构建完成的VH-VL被导入到完整的细胞,如哺乳动物细胞,酵母细胞或者噬菌体中进行展示筛选。该方法已经被成功的用于流感病毒特异性抗体的筛选。
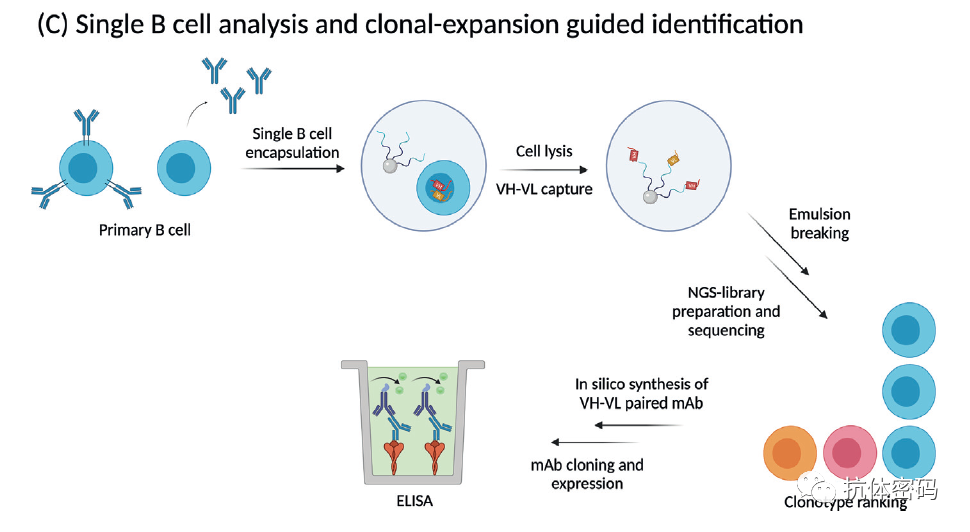
Single B cell repertoire analysis and clonal expansion-guided identification
一种相当新颖的识别抗原特异性B细胞的方法是利用最近开发的单细胞转录组技术,如10xChromium或任何系统或任何使用携带条形码的珠子的系统,如Drop-Seq。这一概念是基于这样一个事实:在免疫或感染后,在所有扩增的克隆(自然配对的VH-VL独特的同源组合)中,抗原特异性B细胞的流行率高。使用传统的批量Ig NGS技术将无法直接传递本地抗原特异性单克隆抗体的遗传信息,因为这些技术无法检索到天然配对的单个VH-VL序列。虽然传统的批量Ig NGS技术有一定的缺陷,但是有研究者使用B细胞测序数据(不是天然配对的VH-VL序列),通过分析克隆扩增、高频克隆和突变负荷等特性,已经证明免疫或感染后,抗原特异性克隆会扩增并进行高频突变。这一概念进一步发展,并且有研究者根据这一概念首次筛选了针对埃博拉病毒的单克隆抗体盘。该抗体盘的建立是通过对免疫埃博拉病毒VLP的BALB/c小鼠中的扩增频率最高的克隆进行分析,并利用PDMS芯片分选技术对B细胞逆转录获得天然配对的VH-VL序列。最终选取扩增最多的VH-VL序列,然后进行合成,克隆到合适的哺乳动物表达载体中,并以重组形式表达,以证实其抗原特异性。
总结
虽然B细胞分选技术已经取得了巨大的进步,但是基于杂交瘤的分选技术目前还是主流,这主要是该技术简单,方便,而且成本较低,不需要昂贵的仪器。相比较而言,新型的技术大多需要特定的仪器,而且技术比较难以掌握,成本高昂。但是,新技术是发展使过去一些比较难以筛选的抗体成为可能,如针对GPCR,离子通道,胞内抗原的抗体的筛选。另外,过去的几年,AI技术在蛋白结构预测方面取得了巨大进步,其在抗体,抗原相互作用预测方面将有较大的帮助,并且可能更好的指导抗体的改造,但是在抗体发现方面,单个B细胞技术还是主要的手段。
参考文献
扫二维码用手机看
新闻资讯
版权所有 © 北京华大蛋白质研发中心有限公司 京ICP备10024265号-4
 京公网安备 11011302002842号
网站建设:中企动力 北京
京公网安备 11011302002842号
网站建设:中企动力 北京


