
新闻动态
NEWS CENTER
近日,加州大学旧金山分校联合亚利桑那大学在Nature上发表了HER2/HER3复合物结构的文章:Structures of the HER2–HER3–NRG1βcomplex reveal a dynamic dimer interface。该文章首次解析了HER2/HER3及配体NRG1β三元复合物的结构,并且从结构上阐明了HER2无法形成同源二聚体的原因,以及为什么HER2 S310F/Y的突变导致较差的预后。

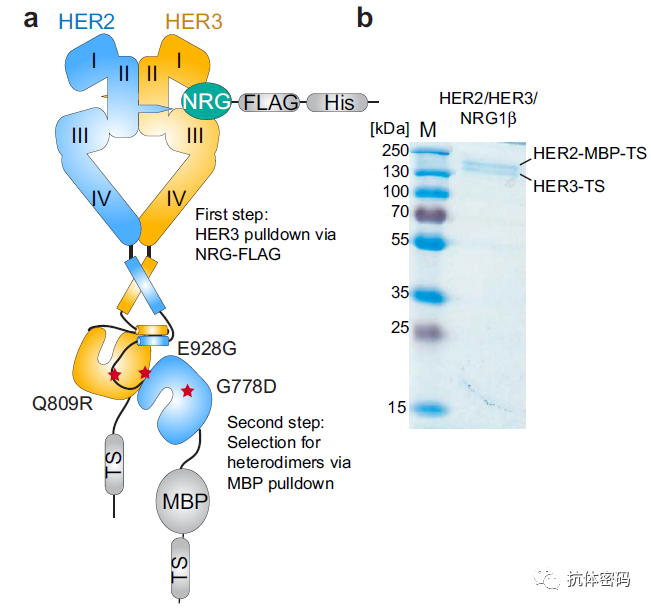
HER2/HER3/NRG设计和复合物样品的制备
在cryo-EM中,好的样品是获得高质量结构的关键,在以往的研究中,HER2/HER3的结构研究都常采用其膜外区,缺乏跨膜区和包内结构,因此两者的复合物不够稳定。本研究中是直接利用细胞表达的几乎全长的HER2和HER3。其设计如下,HER2是全长截去1030–1255后的序列,末端加入MBP和两个串联的链霉素(TS)纯化标签;HER3是全长截去1023–1342后的序列并加入两个TS标签,当然,研究者还进行其它一些突变,以增加HER2/HER3的稳定性及表达量。而配体NRG利用FLAG和His标签纯化,利用大肠杆菌表达。HER2和HER3利用Expi293表达(细胞膜表达,非融合表达),表达后裂解细胞并加入含有HIS标签的NGR结合HER3,暴漏二聚体结合臂的HER3再和HER2结合并形成复合物(具体纯化步骤这里不再详述)。
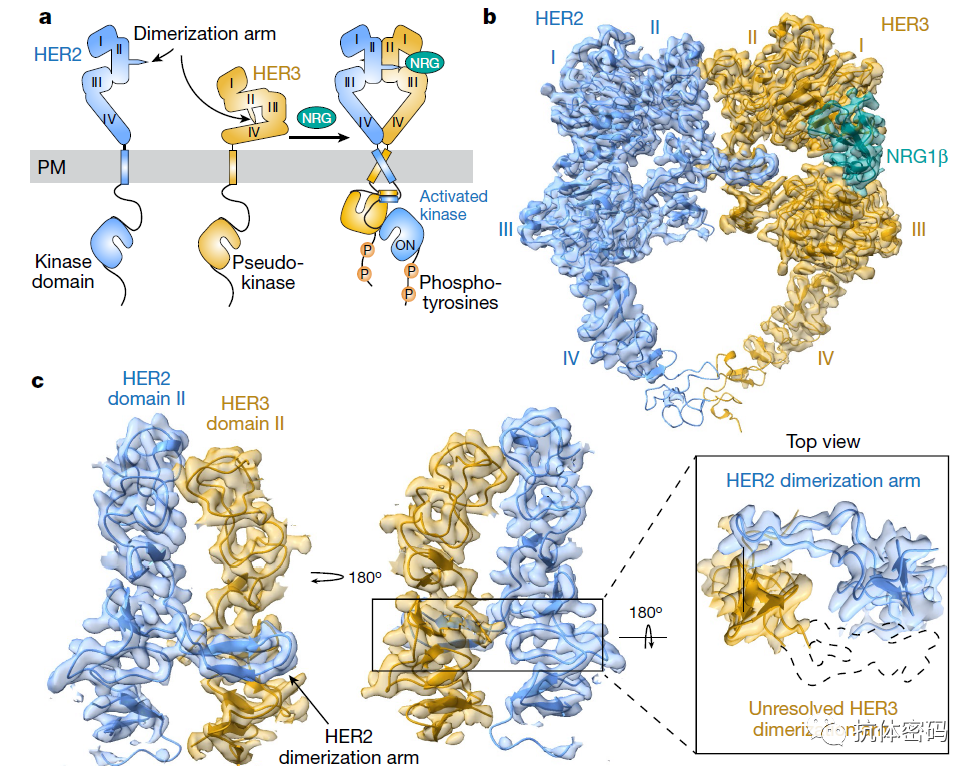
HER2–HER3–NRG1β结构
HER2和HER3的穿膜区和细胞内区域对于复合物结构的稳定具有重要作用,但是在cryo-EM中因其较大的活动性,因此结构不够清晰,但是HER2/HER3的胞外结构与NRG1β复合物的分辨率高达2.9埃。HER2/HER3/NRG1β结构表明,与EGFR 和 HER4的同源二聚体类似,HER2/HER3结构也成“爱心”状,并且两者的第Ⅳ结构域因柔韧性较大,所以结构不够清晰。在该结构中,HER3结合NRG1β配体后处于伸展状态,并且形成“二聚体臂”结合的口袋,HER2以伸展状态与HER3结合,并且其“二聚体臂”结合到HER3的口袋中。在该结构中,HER3的“二聚体臂”结构不够清晰,可能是因为HER2没有配体且天然处于伸展状态,因此无法形成“二聚体臂”结合的口袋,所以HER3的“二聚体臂”无法结合HER2的口袋。
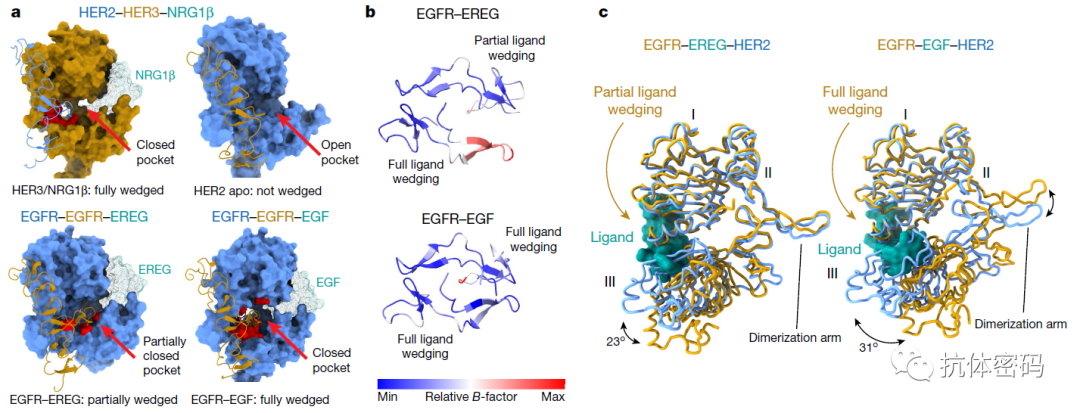
变构控制“二聚体臂”
与EGFR与配体EGF或者EREG的结合类似,HER3和NRG1β的结合也有不同的状态:完全楔入和部分楔入,其中部分楔入被认为是受体和配体结合的一种中间态。当配体半楔入受体时,二聚体臂结合的口袋为半闭合状态,这时其对另外一个二聚体臂的亲合力较弱;当配体完全楔入时,二聚体臂结合的口袋为全闭合状态,其对另外一个二聚体臂有较高的亲合力,因此促进二聚体的形成,并保持其稳定性。因为HER2天然状态下为伸展转台,且没有配体,因此其二聚体臂结合的口袋为打开状态,对HER3二聚体臂的结合能力较弱,因此HER2/HER3的二聚体主要通过HER2的二聚体臂和HER3二聚体臂结合的口袋的结合。
HER2 S310F突变可以稳定二聚体
HER2的 S310F/Y突变多数发生在非HER2过表达的肿瘤中,研究者构建了S310F突变的HER2,并解析了HER2(S310F)–HER3–NRG1β 复合物的结构。与野生型相比,S310F突变后的HER2/HER3异源二聚体更加稳定,这是因为310F和HER3 Y265形成了π–π键,同时也引入了一些极性的接触。该相互作用导致HER3的二聚体臂与HER2的口袋结合能力增强,因此HER3二聚体臂在HER2(S310F)–HER3–NRG1β 复合物中的结构更加清晰。并且HER2和HER3的交界面从原来的1977 Å2增加到3378 Å2,最终导致HER2/HER3二聚体更稳定。

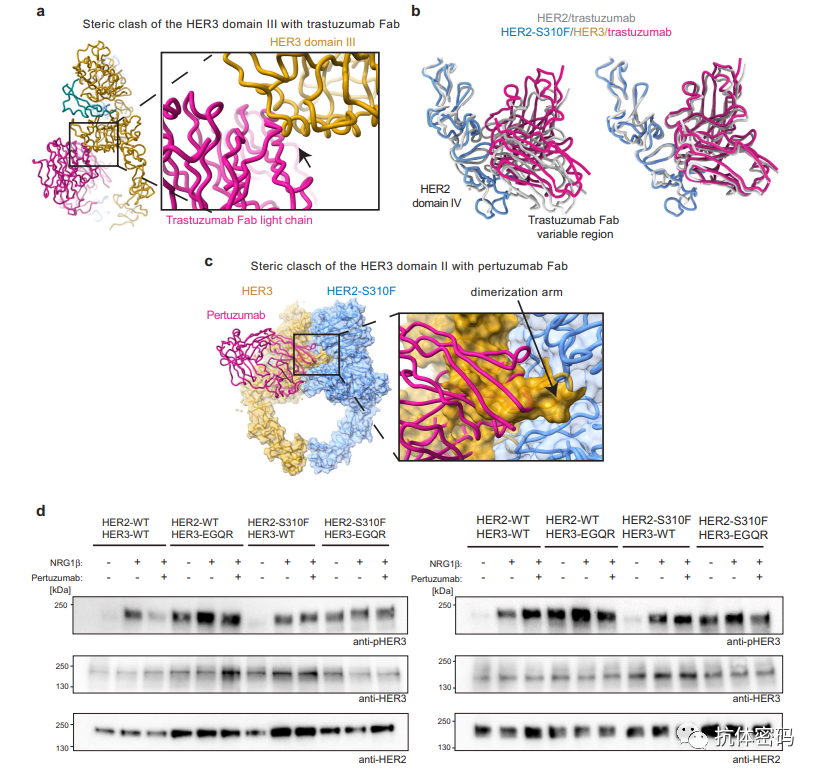
trastuzumab 和pertuzumab的结合
trastuzumab(曲妥珠单抗/赫赛汀) 和pertuzumab(帕托珠单抗)是两个已经批准上市是靶向HER2的单克隆抗体,它们结合的位置下图所示:分别位于HER2的第Ⅳ结构域和第Ⅱ结构域。
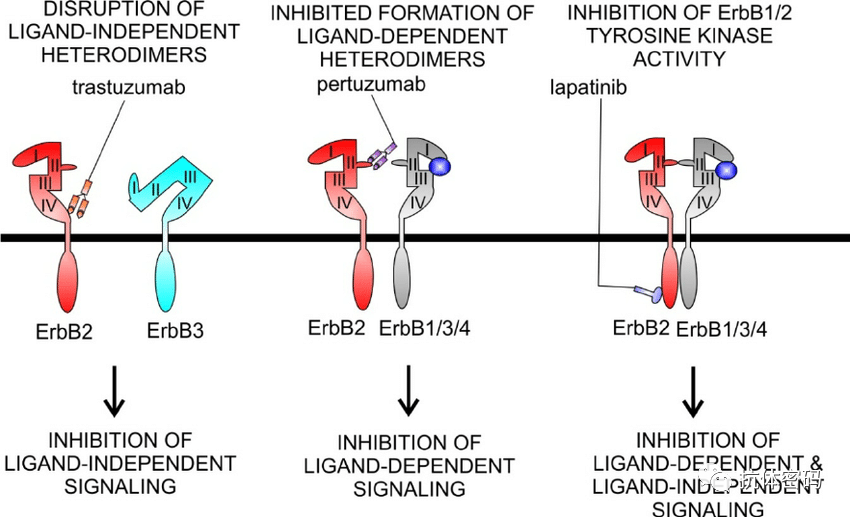
研究表明两个抗体都无法破坏已经形成的HER2/HER3异源二聚体(下图A),trastuzumab结合的第 Ⅳ结构域因为具有较高的柔韧性,因此抗体结合后使HER2的Ⅳ结构域远离HER3,同时HER3的第Ⅲ结构域也会有一定程度的旋转,从而防止与trastuzumab空间位置的冲突。

Pertuzumab因为结合在HER2的二聚体臂上,其可以阻碍NRG1β诱导的HER2/HER3二聚体的形成(Pertuzuma无法破坏已经形成的二聚体)。但是对于S310F突变,两个抗体都无法阻碍NRG1β诱导的HER2/HER3二聚体的形成,而且Pertuzuma也无法结合已经形成的二聚体,这可能是因为该位点的突变直接阻碍了抗体的结合(下图C)。
总结
在以往的结构研究中,研究者都是利用HER2,HER3的胞外区构建复合物,而通过这种方法得到的二聚体往往不够稳定。本文研究者构建了几乎全长的HER2/HER3(因为有研究表明,HER2/HER3的胞内结构域可以稳定异源二聚体),并得到了稳定的复合物结构。
HER2/HER3/NRG1β的结构表明,HER2虽然以“伸展”状态与HER3结合,但是因为其没有配体结合,无法通过构象的变化形成二聚体臂结合的口袋,因此,HER3的二聚体臂无法结合其二聚体臂口袋。这也从侧面表明,在自然状态下HER2虽然以伸展的状态存在,但是其无法通过结合配体形成二聚体臂结合口袋,因此自身无法形成同源二聚体。
S310F/Y突变的HER2与HER3和NRG1β形成复合物结构表明,HER2突变后HER3的二聚体结合臂与310F/Y通过π–π相互作用并稳定二聚体的结构,因此该位点的突变可能通过稳定二聚体激活相关的下游的信号通路。
trastuzumab(曲妥珠单抗/赫赛汀)和pertuzumab(帕托珠单抗)都可以结合HER2/HER3复合物,但是对于S310F突变,Pertuzuma也无法结合已经形成的二聚体,这可能是因为该位点的突变直接阻碍了抗体的结合,这也解释为什么Pertuzuma对S310突变的疗效弱于trastuzumab。
参考文献
1、Devan Diwanji, Raphael Trenker, Tarjani M. Thaker et al. Structures of the HER2–HER3–NRG1β complex reveal a dynamic dimer interface.Nature 2021
扫二维码用手机看
新闻资讯
版权所有 © 北京华大蛋白质研发中心有限公司 京ICP备10024265号-4
 京公网安备 11011302002842号
网站建设:中企动力 北京
京公网安备 11011302002842号
网站建设:中企动力 北京



